Réglementation et ANVISA : BizaLumière comme Partenaire Stratégique en Documentation Analytique et Qualité de Laboratoire
REGULATÓRIO E ANVISA
9/30/20254 min temps de lecture


La régulation pharmaceutique au Brésil est l’un des piliers qui garantit la sécurité, l’efficacité et la qualité des médicaments mis à disposition de la population. L’action de l’ANVISA (Agence Nationale de Surveillance Sanitaire) implique des processus complexes d’évaluation technique, exigeant une documentation précise, des données fiables et des justifications scientifiques solides.
Dans ce contexte, BizaLumière se présente comme un partenaire stratégique pour les entreprises pharmaceutiques, offrant une expertise technique spécialisée qui va bien au-delà de la conformité : nous contribuons à la construction de bases solides pour des décisions réglementaires sûres et des processus de laboratoire cohérents.
Panorama réglementaire et importance de la conformité
La conformité réglementaire n’est pas seulement une obligation légale — c’est un avantage concurrentiel. Les entreprises qui maintiennent des processus structurés peuvent :
Répondre rapidement aux exigences de l’ANVISA
Réduire les risques de refus et de retouches
Garantir la prévisibilité des lancements et des soumissions
Renforcer leur image de qualité et de fiabilité sur le marché
Sans cet alignement, les impacts peuvent inclure des retards, des coûts supplémentaires, des reformulations et même la perte d’opportunités commerciales et de partenariats internationaux.
Points critiques exigés par l’ANVISA :
Cohérence des données analytiques
Clarté des justifications techniques
Adéquation des documents de support
Traçabilité de toutes les étapes documentées
Normes et directives fondamentales de l’ANVISA
L’ANVISA agit en conformité avec les standards mondiaux, adoptant le CTD (Common Technical Document) comme référence internationale pour les soumissions. Parmi les principales normes, on distingue :
RDC 200/2017 – Enregistrement de nouveaux médicaments
RDC 73/2016 – Modifications post-enregistrement
RDC 359/2020 – Règles pour CADIFA et DMF des principes actifs pharmaceutiques
Ces réglementations définissent des critères clairs pour la présentation des dossiers, les exigences de stabilité, le contrôle des impuretés et la compatibilité avec les emballages.
Soumissions techniques : structure CTD
Le format CTD organise les données techniques et réglementaires en modules, facilitant l’analyse par l’ANVISA et alignant les pratiques nationales aux standards internationaux.


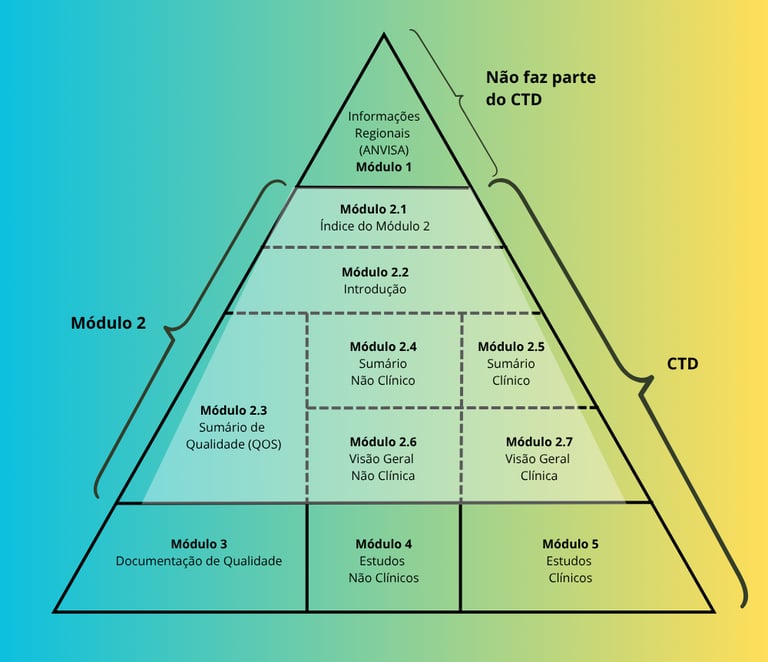
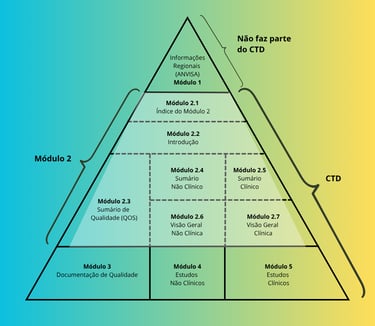
Module 2 (résumés techniques) : regroupe les résumés de qualité, d’efficacité et de sécurité, avec un accent sur la clarté et l’objectivité
Module 3 (qualité) : présente les données analytiques et pharmaceutiques, incluant les spécifications, les méthodes de validation et les études de stabilité
Un dossier bien structuré garantit clarté, cohérence et conformité réglementaire, réduisant les retouches et renforçant la crédibilité de la soumission.
Comment BizaLumière soutient votre entreprise concrètement
Chez BizaLumière, nous offrons une expertise technique spécialisée en :
Élaboration et révision de documents analytiques (méthodes, SOP, URS, spécifications)
Préparation de dossiers CTD (Modules 2 et 3)
Réponses techniques aux exigences de l’ANVISA, avec clarté et fondement scientifique
Investigation de OOS/OOT, écarts et CAPA, avec les outils Ishikawa, 5W2H et FMEA
Évaluation des impuretés et solvants résiduels, avec justifications techniques basées sur les guides ICH
Études de stabilité et de dégradation forcée, essentielles pour définir les durées de conservation
Analyse de compatibilité médicament-emballage, garantissant l’intégrité physico-chimique
Évaluation critique de DMF et CADIFA, assurant la traçabilité et la conformité des ingrédients
Révision de certificats et rapports (CoA, GMP, techniques)
Formation des équipes aux Bonnes Pratiques Analytiques (BPA)
Gestion documentaire et intégrité des données
Réponses réglementaires et support post-soumission
Après la soumission initiale, l’ANVISA peut demander des informations complémentaires. BizaLumière soutient votre équipe dans la construction de réponses techniques fondées, avec :
Organisation logique et clarté de communication
Documents de support cohérents (rapports techniques, certificats, laudos)
Intégration entre données analytiques, pharmaceutiques et réglementaires
Fondement scientifique pour les paramètres critiques comme la pureté, la puissance et la stabilité
Cette approche réduit les risques de retouches et augmente les chances d’acceptation par l’agence.
Gestion des ingrédients et documentation de support
La conformité réglementaire dépend aussi de la qualité des ingrédients et de la traçabilité documentaire. Nous intervenons dans :
Évaluation critique du DMF (Drug Master File) : synthèse, spécifications, méthodes et stabilité
Analyse technique de CADIFA : vérification de la cohérence des processus et conformité aux pharmacopées
Révision rigoureuse des certificats (CoA, GMP, rapports techniques) : authenticité, validité et conformité réglementaire
Tendances et défis du paysage réglementaire
Le secteur réglementaire au Brésil suit les tendances mondiales :
Digitalisation / Plus de rapidité et de traçabilité dans les soumissions
Harmonisation internationale / Facilite les partenariats et la compétitivité mondiale
Exigence de données robustes / Nécessite un investissement technique accru
Focus sur les ingrédients (CADIFA/DMF) / Garantit la sécurité et la qualité tout au long de la chaîne
Les études de stabilité, la compatibilité médicament-emballage et une documentation solide sont de plus en plus valorisées par l’ANVISA, exigeant cohérence technique et applicabilité pratique.
Atouts de BizaLumière
Consultation technique, pas d’audit : focus sur l’applicabilité réelle
Équipe spécialisée dans les documents analytiques qui soutiennent les décisions réglementaires
Clarté, cohérence et standardisation du langage scientifique
Service personnalisé et suivi post-soumission
Engagement envers les délais et la routine de l’industrie pharmaceutique
Conclusion : votre base technique avec BizaLumière
Chez BizaLumière, nous comprenons que la qualité réglementaire repose sur des bases solides de documentation, de données fiables et de décisions techniques bien justifiées.
Au-delà de la conformité, nous offrons une intelligence réglementaire et une structure analytique pour transformer les défis en solutions pratiques.
👉 Contactez-nous et découvrez comment nous pouvons soutenir votre équipe avec une véritable expertise technique.
BizaLumière
Consultation spécialisée en documentation technique et exigences réglementaires analytiques
ContaCT
newsletter
© 2025. BizaLumière. All rights reserved.

Privacy Policy
